中学2年生の理科では、「原子と分子」と「化学変化」という単元を学習します。
原子と分子の特徴を抑え、科学変化によってどのようなことが起きているのか、またその具体例と実験について覚えなkればなりません。
そこでこの記事では、この単元が苦手という中学生やそして中学生に勉強を教える親御さんのために抑えておくべき重要なポイントをわかりやすくまとめたので参考にしてください。
原子と分子
原子と分子それぞれの特徴を押さえましょう。
原子
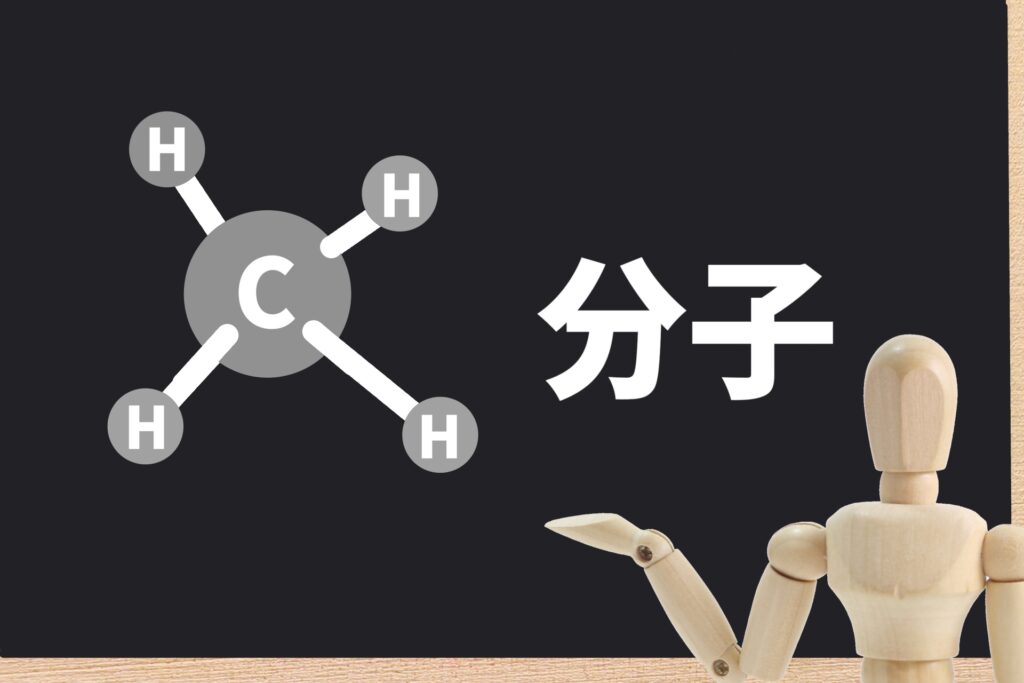
原子・・・それ以上分けることのできない最小の粒子のこと。
原子は次のような特徴を持っています。
- 原子は別の原子に変化しない
- 原子は何も無いところから発生したりしない
- 原子は無くなったり消えたりしない
- 元素・・・物質をつくるもととなる成分のこと。
分子
分子・・・原子がいくつかくっついたもので、物質の性質が初めて現れる最小の構成。
※水素原子は燃えないけど、水素分子になって初めて燃えるという感じで覚えると良いかと思います。
※常温で液体・気体の物質は分子を作るが、常温で固体の物質は分子を作らない。
物質の分類
身のまわりの物質は次のように分類できます。
- 単体・・・1種類の原子から出来ている物質
- 化合物・・・2種類以上の原子から出来ている物質
- 純物質・・・混じり気の無い物質
- 混合物・・・2種類以上の純物質が混じってできている物質
化学変化

化学変化とは、物質が反応の前後で原子の組み合わせを変えて、もとと異なる物質となることです。
化学変化の前後では、原子の組み合わせが変わりますが、原子の数と種類は変わらないという点を押さえましょう。
化学変化の分類は以下の通りとなっており、それぞれの意味を覚えましょう。
- 化合・・・2種類以上の物質が1種類の物質となる反応
- 酸化・・・化合の中でも、酸素と結びつく反応
- 燃焼・・・酸化の中でも、熱や光を出しながら激しく酸素と結びつく反応
- 分解・・・1種類の物質が2種類以上の物質に分かれる反応
- 熱分解・・・分解の中でも、熱を使って分解する反応
- 電気分解・・・分解の中でも、電気を使って分解する反応
- 還元・・・酸化物から酸素を取り除く反応
分解
炭酸水素ナトリウムの熱分解は以下のような化学変化が起きています。
{2NaHCO}{3} → {Na}{2}{CO}{3} + {CO}{2} + {H}_{2}{O}
炭酸水素ナトリウム → 炭酸ナトリウム(固体) + 二酸化炭素(気体) + 水(液体)
それぞれの物質の確認方法は以下の通りです。
- 炭酸水素ナトリウム・・・弱アルカリ性の物質でフェノールフタレイン溶液をうすいピンク色にする。また、白い物質で水に溶けにくい。
- 炭酸ナトリウム・・・強アルカリ性の物質でフェノールフタレイン溶液を濃い赤色にする。また、白い物質で水に溶けやすい。
- 水・・・青色の塩化コバルト紙を赤色に変える。
- 二酸化炭素・・・石灰水を白く濁らせる。
水の電気分解の科学変化をみてみましょう。
{2H}{2}{O} → {2H}{2} + {O}{2}
水 → 水素 + 酸素
それぞれの物質の確認方法を以下の通りです。
- 水素・・・マッチの火を近づけるとポッと音を立てて燃える。(陰極で発生)
- 酸素・・・線香の火を近づけると、炎が激しくなる。(陽極で発生)
- 発生する体積比は化学反応式の係数より 水素:酸素=2:1 となる。
化合
鉄と硫黄の化合の変化を見てみましょう。
{Fe} + {S} → {FeS}
鉄 + 硫黄 → 硫化鉄
実験中の注意点として鉄と硫黄の混合物を加熱することで、赤くなるのを確認したらガスバーナーの火を切るという点です。
マグネシウムと酸素の化合(燃焼)の科学変化はどうでしょうか。
{2Mg} + {O}_{2} → {2MgO}
マグネシウム + 酸素 → 酸化マグネシウム
マグネシウムは加熱することで、酸素と結びつく際に熱や光を出しながら激しく反応する。
マグネシウム・・・黒色の物質
酸化マグネシウム・・・白色の物質
酸化と還元
「酸化」はは化合の中でも、酸素と結びつく反応です。
「還元」は酸化物から酸素を取り除く反応です。
酸化銅と炭素を混ぜて加熱する実験を化学式で表すと以下になります。
{2CuO} + {C} → {2Cu} + {CO}_{2}
この時、酸化銅は還元、炭素は酸化されています。
酸化銅と水素を混ぜて加熱すると以下のような化学式になります。
{CuO} + {H}{2} → {Cu} + {H}{2}{O}
酸化銅は還元され、水素は酸化されています。


